La spettroscopia protonica nello studio delle neoplasie intra-craniche
T. Popolizio, F. Nemore, G.M. Giannatempo, A. Stranieri, T. Scarabino
Servizio di Neuroradiologia
Dipartimento di diagnostica per Immagini
IRCCS " Casa Sollievo della Sofferenza "
San Giovanni Rotondo ( FG )
INTRODUZIONELa diagnosi differenziale di lesioni focali intra-craniche dipende dall'abilità e dall'esperienza del neuroradiologo di interpetrare , sulla base di aspetti clinici, una serie di informazioni dirette, ma anche indirette, fornite dall'imaging . Queste informazioni sono rappresentate dalla sede, dalla presenza di edema e di eventuale effetto massa, dal riscontro di calcificazioni e/o formazioni cistiche, dalla vascolarizzazione e dalla dinamica del CE, dall'età e dalla presentazione clinica del tumore. Tuttavia la differenziazione tra lesioni ischemiche pseudo-tumorali, tumori intra ed extra-assiali, discriminazione tra alto e basso grado, spesso resta molto difficile se basata soltanto su i criteri descritti. In contrasto con la TC ,la RMI e l'angiografia , la Spettroscopia protonica a RM è in grado di fornire informazioni strutturali, relative all'integrità neuronale, alla proliferazione e degradazione cellulare, al metabolismo energetico, alla trasformazione necrotica dell'encefalo o del tessuto tumorale. In virtù di tali caratteristiche tale metodica apporta un valido aiuto all'imaging tradizionale nella diagnosi differenziale tra lesione intrassiale gliale e non;
nella valutazione del grado di anaplasia cellulare dei tumori , dell'estensione anatomica dei gliomi e dell'edema peri-tumorale; infine, nel monitoraggio della evoluzione della malattia neoplastica, soprattutto dopo trattamento chirurgico e/o radioterapico, ossia differenziazione del danno da radionecrosi - dal residuo o recidiva tumorale.
Nel presente lavoro ci proponiamo di fornire, sulla base della più recente letteratura e sulla nostra personale esperienza , una interpetrazione dei dati spettroscopici delle più frequenti neoplasie cerebrali alla luce di una integrazione di aspetti morfologici e dati neuro-chimici tumorali.
Significato e Ruolo dei principali metaboliti in ambito neoplasticoL'esame spettroscopico evidenzia, nella maggior parte dei tumori, anomalie metaboliche legate a 5 metaboliti maggiori : N-acetil aspartato (NAA), complesso creatina-fosfoCr (Cr/PCr), Colina (Cho), acido lattico( Lac ) e lipidi( Lip). Accanto a questi, si associano altri metaboliti meno noti ma non meno importanti quali ad esempio il MioInosito ( mI ) , l'alanina ( Ala ) , il GABA, la taurina che, in alcuni casi, possono essere utili nella diagnosi differenziale di alcune lesioni intra-craniche .
L'eterogeneità isto-patologica che è tipica delle lesioni tumorali e che comprende non solo la presenza di necrosi o cisti intra-tumorali ma anche la presenza di foci cellulari caratterizzati da gradi differenti di anaplasia, spiega i differenti profili metabolici spettroscopici di ciascuna neoplasia ed anche le difficoltà diagnostico-interpetrative che, a volte, impediscono una diagnosi di certezza.
Il significato biochimico dei vari metabolici è ormai noto (12).
L'NAA è generalmente riconosciuto con marker dei neuroni e delle loro componenti incluso i dendridi, per cui quando il tessuto cerebrale è danneggiato o è sottoposto ad un processo distruttivo, degenerativo o infiltrativoesso si riduce marcatamente. Le lesioni extra-assiali che non abbiano infiltrato il cervello o che non contengano tessuto neurogliare non mostrano alcuna risonanza di NAA .
La Cr è considerata un indicatore del metabolismo energetico. Poiché la Cr è abbastanza costante in varie condizioni metaboliche, essa è spesso usata come riferimento interno standard per la valutazione semi-quantitativa di altri metaboliti cerebrali.
Quando presente, la modificazione del picco della Cr riflette il particolare assetto del metabolismo basale delle cellule neoplastiche il quale, sfruttando prevalentemente la via glicolitica , reprime in parte l'attività enzimatica della creatin-chinasi, riducendo la concentrazione cellulare del complesso Cr/PCr. Vi sono tumori come i meningiomi e le metastasi che sono caratterizzati da una drastica riduzione del segnale della Cr poiché mancano completamente del complesso enzimatico Cr-PCr-chinasi ( 1).
La Cho proviene principalmente da intermediari del metabolismo dei fosfolipidi come la fosfo-Cho e la glicerofosfo-Cho, ciascuna delle quali gioca un ruolo importante nella struttura e nella funzione delle cellule di membrana . Conseguentemente l'incremento della Cho può essere riscontrato in processi di elevato tournover cellulare di membrana come la proliferazione tumorale o lo sviluppo dell'encefalo ma anche in processi di disfacimento e degradazione delle membrane secondari a qualsiasi noxa patogena.
I Lipidi ed il lattato sono fisiologicamente assenti nell'encefalo sano. Studi in vitro hanno mostrato che l'ammontare dei Lip, riscontrato con la spettroscopia, si correla bene con il grado di micro e macro-necrosi (8)visto in istologia.
Il Lac dell'encefalo è prodotto attraverso la glicolisi anaerobia ed indica condizioni tossiche come un consumo ipermetabolico di glucosio (9). Questo metabolita, normalmente non è misurabile nel cervello perchè la sua concentrazione è inferiore ai limiti di sensibilità della MRS . La sua presenza è rilevabile in presenza di molteplici cause , accomunate dalla indisponibilità cellulare di O2 ( aumento del metabolismo basale ,deficit della perfusione, deficiente deflusso vascolare venoso,con conseguente accumulo di Lac per meccanismo di sequestro sopratutto nel contesto di componenti cistiche o necrotiche) , ma è anche dovuta ad alterazioni enzimatiche mitocondriali. Ne consegue che, pur essendo un metabolita di frequente riscontro nello studio dei tumori, contrariamente a quanto segnalato da alcuni autori, non fornisce indicazioni sul grado di malignità cellulare ( 1 ).
La scelta del TE influenza il numero dei metaboliti misurabili. Con lunghi TE (136-272 ms) viene garantito il segnale dei principali metaboliti (Cho, CR e NAA ) con una buona qualità spettrale.
Di contro brevi TE (10-50 ms) permettono di visualizzare anche altri metaboliti quali mioinositolo ( mI ), Glutammato, Glutamina, Glicina, Aspartato, Taurina, Alanina. In particolare, il mI è considerato un marker gliale (7). Poiché la maggior parte degli studi utilizza TE lunghi i dati forniti dalla letteratura risultano pochi ed a volte discordanti; è tuttavia ormai accertato che il segnale del mI sarebbe elevato nei gliomi di basso grado e basso nei gliomi maligni. Quali markers specifici di tipo istologico di neoplasia, in letteratura vi sono segnalazioni di tali metaboliti cosiddetti "minori " , riscontrati in tipi specifici di tumori; ad esempio l'Alanina, rappresentata da un doppio picco deflesso a 1.5 ppm, da alcuni autori riscontrata nei meningiomi , sembra svolgere un ruolo importante nella diagnosi differenziale tra meningiomi e neurinomi ( 9 ). Inoltre , la glicina è stata descritta in casi di glioblastomi e la taurina nel medulloblastoma ( 7). Il riscontro di tali metaboliti è tuttavia sporadico , per cui non è ancora possibile asserire che vi siano markers biochimici specifici di un determinato tipo di neoplasia, rilevabili in vivo; la presenza di tali amminoacidi sembrerebbe riflettere specifici aspetti del metabolismo del tumore che ci sono ancora sconosciuti.
Applicazioni cliniche e diagnosi differenzialiUn dato comune alle metastasi ed ai tumori primitivi cerebrali è il riscontro di un un incremento della Cho ed un decremento di NAA (9) Poiché le lesioni non neoplastiche come ad esempio un infarto cerebrale o un ascesso sono caratterizzate da un marcato decremento della Cho, questa può differenziare le lesioni neoplastiche (elevata Cho) da quelle non neoplastiche. Infatti, l'aumento della Cho, che risulta essere statisticamente più elevato nei gliomi altamente maligni rispetto a quelli di basso grado, risulta essere marker istochimico di proliferazione (11), in accordo con i dati pubblicati recentemente, che mostrano una correlazione positiva di Cho/Cr con il grading istologico di astrocitomi e la marcatura del ki-67. Anche la concomitanza di Lac e Lip, essendo espressione di necrosi cellulare rappresenta una caratteristica del metabolismo dei tumori maligni . Appare quindi che nonostante le possibili ed ampie sovrapposizioni di valori tra gradi intermedi, la 1H-MRS può differenziare gradi estremi di anaplasia. Il glioma di basso grado è generalmente caratterizzato da un modesto aumento della Cho, una variabile riduzione di NAA e una incostante presenza di Lac; al contrario, i gliomi maligni presentano una elevata quantità di Cho, una accentuata riduzione di NAA (e a volte anche di Cr/PCr) e la presenza combinata sia di Lac che di Lip ( 15 ).
Le metastasi, d'altro canto, mostrano un variabile incremento di Cho e riduzione di Cr ed NAA; ciò le distingue dalle masse non neoplastiche ad intenso CE, per esempio di natura infiammatoria, mentre il loro prominente picco di Lip (8) le differenzia dai glomi ad alto grado. La spiegazione isto-chimica della presenza dei Lip nelle metastasi e la loro assenza nelle masse tumorali cerebrali primitive può essere attribuito da un lato alla crescita veloce e più superficiale delle metastasi rispetto ad una più infiltrante e profonda dei tumori primitivi e, dall'altro, al fatto che le cellule cancerogene di origini differenti con potenziale capacità di metastatizzare sono caratterizzate da Lip mobili nelle loro membrane cellulari, invece assenti nelle membrane delle cellule neoplastiche primitive.
D'altro canto i lipidi , pur generalmente assenti nei gliomi anaplastici ed in quelli a basso grado, sono invece di frequente riscontro nei glioblastomi a causa delle ampie zone di necrosi, per cui la loro presenza in una massa espansiva intracranica a caratteri infiltranti è considerata elemento discriminante tra glioblastomi multiformi e glomi di differente grading.
I medulloblastomi (Pnet) mostrano un alto segnale di Cho ( con differenze statisticamente significative tra i gliomi di alto grado) , un decremento di NAA e Cr e una assenza di Lac e Lip. Questi dati riflettono bene il corso clinico del medulloblastoma come tumore a rapido sviluppo con alta proliferazione ( 9,14 ).
Gli studi clinici di 1H-MRS eseguiti con l'obiettivo di individuare possibili modificazioni biochimiche capaci di differenziare la natura lesioni cistiche infettive e lesioni cistiche neoplastiche, primitiva e/o metastatica (6), hanno dimostrato che lo spettro relativo a cisti infiammatorie ( es. ascessi cistici ) si presenta alquanto vario per la presenza di Lac, Lip , acetato (1.9ppm), succinato (2.4ppm), Ala (1.5ppm) e Valina o Leucina (0.9ppm) , invece i tumori cistici puri pur mostrando Lip ed acido lattico non contengono altri amminoacidi. Questi metaboliti, cosiddetti minori, sono costantemente riportati in ogni serie di lesioni ascessuali pubblicate e rappresentano presumibilmente il risultato finale di processi di fermentazione operati dal microrganismo patogeno.
Lo spettro protonico dei tumori extra-assaili , meningiomi e neurinomi, non presenta alcun picco riferibile a NAA; la presenza di variabili quantità di NAA è attribuita alla contaminazione del voxel con tessuto cerebrale adiacente. Inoltre, la riduzione di Cr dovuta a rallentamento del metabolismo energetico in questi tumori, rende ragione dell'elevato rapporto Cho/ Cr ; pertanto la Cr non può deve utilizzata come standard di riferimento . Sebbene l'aumento della Cho sia più rilevante nei meningiomi rispetto ai neurinomi, il fattore discriminante per differenziarli è, secondo alcuni studi, la presenza di Ala ( doppio picco deflesso a 1.5 ppm) nei meningiomi e quella di mI nei neurinomi ( 7,11 ).
Nella trattazione della patologia tumorale intar-cranica non si può prescindere dalla valutazione dei margini della neoplasia, dell'edema periferico e della differenziazione tra recidiva e necrosi post-radioterapica. Con la diagnostica convenzionale , è ormai noto che il margine tumorale radiologicamente definibile nella maggior parte dei casi non corrisponde a quanto riscontrato all'esame istologico. Questo perché può essere presente una infiltrazione subdola del parenchima cerebrale, più estesa del margine radiologicamente apprezzabile, che la MR non è in grado di rilevare. L'esame di spettroscopia multivoxel , viceversa, offre al chirurgo la possibilità di conoscere con una buona precisione, la reale estensione tumorale in virtù del fatto che le caratteristiche spettroscopiche dell'edema cerebrale sono quelle del parenchima normale mentre il parenchima cerebrale infiltrato presenta tutte quelle alterazioni spettroscopiche descritte.
Anche il profilo metabolico della radionecrosi è caratterizzato dalla riduzione della concentrazione di tutti i metaboliti normali (Cho, NAA, Cr) fino allo loro completa assenza e dalla presenza di un segnale in un ampio range di frequenza, compreso tra 0.8 e 1.2ppm, che deriva dalla sovrapposizione dei segnali dei prodotti di disfacimento cellulare (acidi grassi e proteine citosoliche) e dal Lac (10,13). Il profilo metabolico di aree neoplastiche evolutive presenta invece un costante aumento di segnale della Cho. Tuttavia va sottolineato che per la differenziazione della radionecrosi da un tumore in progressione o da una recidiva è sempre indispensabile integrare la spettroscopia alla RM convenzionale ed il follow-up. Le informazioni metaboliche possono ridurre il numero di procedure diagnostiche addizionali , facilitare l'interpetrazione delle immagini RM ma non possono, da sole, condurre ad una diagnosi di certezza.
CONCLUSIONIAlla luce di quanto detto e dei risultati riportati da una numerosa letteratura, riteniamo di poter affermare che l'esame spettroscopico, effettuato a completamento della risonanza magnetica convenzionale fornisca, soprattutto nell'ambito della patologia neoplastica cerebrale, delle importanti informazioni additive che portano ad un numero significativamente più alto di diagnosi corrette . La sua utilità maggiore risiede attualmente nella possibilità di operare un grading tumorale nelle lesioni gliali , nel monitoraggio evolutivo della malattia neoplastica e nella diagnosi differenziale tra recidiva e radionecrosi.
Ci aspettiamo in un futuro prossimo una maggiore diffusione della metodica che permetta un dialogo professionale più ampio e proficuo , in questo interessante ambito diagnostico.
DIDASCALIE
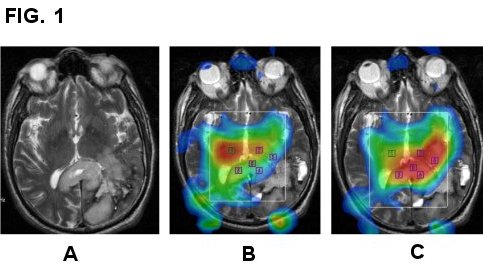
Foto 1 ( A,B,C )
Glioblastoma dello splenio del corpo calloso.
In A : sequenza FSE T2-p morfologica
In B :mappa di NAA, che appare ridotto nella sede della lesione; In C: mappa della Cho, notevolmente aumentata
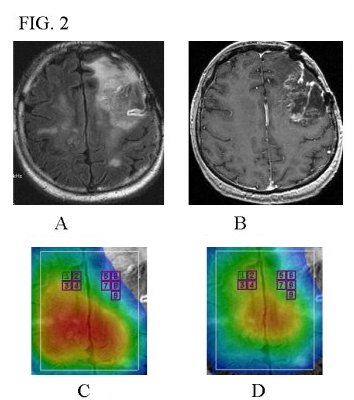
Fig. 2 (A,B,C , D)
Esiti di intervento di asportazione di neoplasia cerebrale frontale sinistra.
In A: studio FSE T2-p morfocologico; in B: studio SE T1-p dopo mdc
In C e D : mappa di NAA e Cho, entrambi ridotti nella sede dell'esito chirurgico.
BIBLIOGRAFIA- Bianchi MC, Tosetti M, Canapicchi R: Tumori cerebrali. In M, Cammisa, T. Scarabino, T Popolizio et Al: Progressi in RM. Spettroscopia protonica cerebrale. Gnocchi Editore, Napoli, pg 29-43,1999
- Brand A., Richter-Landsberg C.,Leibfritz D.: Multinuclear NMR stu dies on the energy metabolism of guai and neuronai celis. Dev Neurosci 15:289-298, 1993.
- 37. De Stefano N, Caramanos Z, Preul et Al: In vivo differentiation of astro cytic brain tumours and isolated demyeiinating lesions of the type seen in multiple scierosis using 'H magnetic resonance spectroscopic imaging. Ann Neurol 44:273-278,1998
- 30. Go KG, Kamman RL, Mooyaart EL et Al: Localised proton spectroscopy and spectroscopic imaging in cerebral gliomas, with comparison to positron emission tomography. Neuroradiology 37:198-206,1995
- 16. Herminghaus N Mòller-Hartmann W, Wittsack J et Al: Grading of astrocytomas using spectral pattern recognition analysis of in vivo spectroscopic data. Riv Neuroradiol 11:81-83,1998
- 22. Kim SH, Chang KH, Song IC et Al: Brain abscess and brain tumour:discrimination with in vivo H-l MR spectroscopy. Radiology 204:239-245,1997
- 21. Kinoshita Y, Yokota A.: Absolute concentrations of metabolites in human brain tumors using in vitro proton magnetic resonance spectroscopy. NMR Biomed 10: 2-12, 1997.
- 10. Kuesel AC, Sutherland GR, Hailiday W et al : 1H-MRS of high grade astrocytomas: mobile lipid accumulation in necrotic tissue. NMR Biomed 7:149-155,1994
- Moller-Hartmann W, Herminghaus S, Krings T et Al: Clinical application of proton magnetic resonance spectroscopy in the diagnosis of intracranial mass lesions. Neuroradiology 44:371-381,2002
- Rabinof J, Lani Lee P, Barker Frederick: in vivo 3T MR spectroscopy in the distinction of recurrent glioma versus radiation effects: initial experience. Radiology 225( vol3 ) : 871-879, dic 2002
- 38. Sallinen PK, Sallinen SL, Helen PT et Al: Grading diffusely infiltrating astrocyto mas by quantitative histopathology, cell proliferation and image cytometric DNA analysis. Comparison of 133 tumours in the context of the WHO 1979 and WHO 1993 grading schemes. Neu ropathol Appi Neurobiol 26:319-331,2000
- Scarabino T, Popolizio T, Giannatempo GM e Coll: Spettro protonico. In M, Cammisa, T. Scarabino, T Popolizio et Al: Progressi in RM. Spettroscopia protonica cerebrale. Gnocchi Editore, Napoli, pg 11-18, 1999
- Schlemmer HP, Bachert P, Henze M et al: Differentiation of radiation necrosis from tumor progression using proton magnetic resonance spectroscopy. Neuroradiology 44 : 216-222,2002
- 39. Tamiya T, Kinoshita K, Ono Y, et Al: Proton magnetic resonance spectroscopy reflects cellular proliferative activity in astrocytomas. Neuroradiology 42:333-338,2000
- Tedeschi G, Lundbom N, Raman R et Al: Increased choline signal coinciding with malignant degeneration of cerebral gliomas: a serial proton magnetic resonance spectroscopy imaging study. J Neurosurg 87:516-524,1997